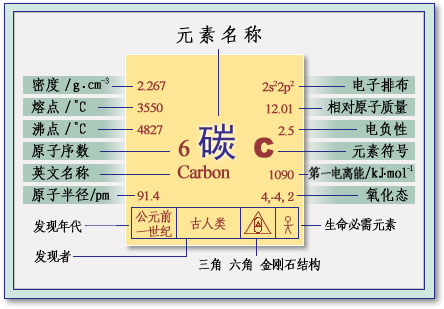
碳元素是什么
的有关信息介绍如下:碳的英文名称来自于拉丁语“carbo”(木炭)一词。由于碳元素在自然界天然存在,它是人类最早认识的化学元素之一。它与铁、硫、铜、银、锡、锑、金、汞、铅等都是古代人早就认识到的化学元素。碳元素是自然界中分布最为广泛的基础元素之一。自然界中以游离状态存在的碳有金刚石、石墨和煤。碳元素的发现与确认,经历了漫长艰苦的历程,是科学技术发展史上的一项重要成就。北京周口店地区遗址就有单质碳的存在,时间可以上溯到大约50万年以前。从新石器时代人类开始制造陶器起,炭黑就被用来作为黑色颜料制造黑陶。战国时代(公元前403一前221年)我国就已用木炭炼铁。随着冶金业的发展,人们在寻找比木炭更廉价的燃料时,找到了煤。据《汉书·地理志》记载:“豫章郡(现今江西省南昌市附近)出石,可燃为薪。”汉代文献《盐铁论》日:“故盐冶之大业,皆依山川,近铁炭。”中国考古工作者在山东平陵县汉初冶铁遗址中发现了煤块,说明中国汉朝初期,即公元前200年就已用煤炼铁了。碳的汉字来自于“炭”。因我国古时称煤为“炭”,遂造为“碳”。到19世纪初,科学家们发现,碳元素是组成生物体最基本的元素。
请选择搜索范围 企业目录 产品目录 二手设备 求购信息 备品备件 行业资讯 行业论文 技术专利 行业标准 行业书籍 企业招聘 人才资源 友情链接 企业管理 行业论坛 会员注册 | 二级域名申请 | 我能做什么? | 网站说明书 | 协议书下载 | 广告预定 | 企业邮局 | 标准库 | 关于我们
免费法律咨询
首页 企业目录 产品目录 求购信息 二手设备 备品备件 行业资讯 行业论文 行业标准 技术专利 企业管理 行业书库 人才招聘 专家介绍 技术交流 友情链接 我的交易区
技术交流首页 | 登录 | 用户注册 | 今日新帖 | 搜索 | 我的收藏夹 | 插件: 万年历 | 杭州公交线路查询
您当前的位置: 中国气体分离设备商务网 → 技术交流 --> 工业气体在国民经济中的应用专题系列讲座 --> 帖子:“碳元素的介绍”
收藏此帖
帖子主题:碳元素的介绍
楼主:shaoys [2006-3-18 下午 02:49:53]
碳元素的介绍
碳,CARBON,源自carbo,也就是木炭,这种物质发现得很早,上图显示出它的三种自然形式:钻石、炭和石黑。碳的无数化合物是我们日常生活中不可缺少的物质,产品从尼龙和汽油、香水和塑料,一直到鞋油、滴滴涕和炸药等,范围广泛种类繁多。
碳的发现简史
碳可以说是人类接触到的最早的元素之一,也是人类利用得最早的元素之一。自从人类在地球上出现以后,就和碳有了接触,由于闪电使木材燃烧后残留下来木炭,动物被烧死以后,便会剩下骨碳,人类在学会了怎样引火以后,碳就成为人类永久的“伙伴”了,所以碳是古代就已经知道的元素。发现碳的精确日期是不可能查清楚的,但从拉瓦锡(Lavoisier A L 1743—1794法国)1789年编制的《元素表》中可以看出,碳是作为元素出现的。碳在古代的燃素理论的发展过程中起了重要的作用,根据这种理论,碳不是一种元素而是一种纯粹的燃素,由于研究煤和其它化学物质的燃烧,拉瓦锡首先指出碳是一种元素。
碳在自然界中存在有三种同素异形体——金刚石、石墨、C60。金刚石和石墨早已被人们所知,拉瓦锡做了燃烧金刚石和石墨的实验后,确定这两种物质燃烧都产生了CO2,因而得出结论,即金刚石和石墨中含有相同的“基础”,称为碳。正是拉瓦锡首先把碳列入元素周期表中。C60是1985年由美国休斯顿赖斯大学的化学家哈里可劳特等人发现的,它是由60个碳原子组成的一种球状的稳定的碳分子,是金刚石和石墨之后的碳的第三种同素异形体。
碳元素的拉丁文名称Carbonium来自Carbon一词,就是“煤”的意思,它首次出现在1787年由拉瓦锡等人编著的《化学命名法》一书中。碳的英文名称是Corbon。
碳单质
碳在地壳中的质量分数为0.027%,在自然界中分布很广。以化合物形式存在的碳有煤、石油、天然气、动植物体、石灰石、白云石、二氧化碳等。
截止1998年底,在全球最大的化学文摘——美国化学文摘上登记的化合物总数为18.8百万种,其中绝大多数是碳的化合物。
众所周知,生命的基本单元氨基酸、核苷酸是以碳元素做骨架变化而来的。先是一节碳链一节碳链地接长,演变成为蛋白质和核酸;然后演化出原始的单细胞,又演化出虫、鱼、鸟、兽、猴子、猩猩、直至人类。这三四十亿年的生命交响乐,它的主旋律是碳的化学演变。可以说,没有碳,就没有生命。碳,是生命世界的栋梁之材。
纯净的、单质状态的碳有三种,它们是金刚石、石墨、C60。它们是碳的三种同素异形体。
金刚石
石墨
碳六十
金刚石
金刚石晶莹美丽,光彩夺目,是自然界最硬的矿石。在所有物质中,它的硬度最大。测定物质硬度的刻画法规定,以金刚石的硬度为10来度量其它物质的硬度。例如Cr的硬度为9、Fe为4.5、Pb为1.5、钠为0.4等。在所有单质中,它的熔点最高,达3823K。
金刚石晶体属立方晶系,是典型的原子晶体,每个碳原子都以sp3杂化轨道与另外四个碳原子形成共价键,构成正四面体。这是金刚石的面心立方晶胞的结构。
由于金刚石晶体中C—C键很强,所有价电子都参与了共价键的形成,晶体中没有自由电子,所以金刚石不仅硬度大,熔点高,而且不导电。
室温下,金刚石对所有的化学试剂都显惰性,但在空气中加热到1100K左右时能燃烧成CO2。
金刚石俗称钻石,除用作装饰品外,主要用于制造钻探用的钻头和磨削工具,是重要的现代工业原料,价格十分昂贵。
石墨
石墨乌黑柔软,是世界上最软的矿石。石墨的密度比金刚石小,熔点比金刚石仅低50K,为3773K。
在石墨晶体中,碳原子以sp2杂化轨道和邻近的三个碳原子形成共价单键,构成六角平面的网状结构,这些网状结构又连成片层结构。层中每个碳原子均剩余一个未参加sp2杂化的p轨道,其中有一个未成对的p电子,同一层中这种碳原子中的m电子形成一个m中心m电子的大∏键(键)。这些离域电子可以在整个儿碳原子平面层中活动,所以石墨具有层向的良好导电导热性质。
石墨的层与层之间是以分子间力结合起来的,因此石墨容易沿着与层平行的方向滑动、裂开。石墨质软具有润滑性。
由于石墨层中有自由的电子存在,石墨的化学性质比金刚石稍显活泼。
由于石墨能导电,有具有化学惰性,耐高温,易于成型和机械加工,所以石墨被大量用来制作电极、高温热电偶、坩埚、电刷、润滑剂和铅笔芯。
碳六十
20世纪80年代中期,人们发现了碳元素的第三种同素异形体——C60。我们从以下三个方面介绍C60
碳六十的发现和结构特点
碳六十的制备
碳六十的用途
碳六十的发现和结构特点
1996年10月7日,瑞典皇家科学院决定把1996年诺贝尔化学奖授予Robert FCurl,Jr(美国)、Harold WKroto(英国)和Richard ESmalley(美国),以表彰他们发现C60。
1995年9月初,在美国得克萨斯州Rice大学的Smalley实验室里,Kroto等为了模拟N型红巨星附近大气中的碳原子簇的形成过程,进行了石墨的激光气化实验。他们从所得的质谱图中发现存在一系列由偶数个碳原子所形成的分子,其中有一个比其它峰强度大20~25倍的峰,此峰的质量数对应于由60个碳原子所形成的分子。
C60分子是以什么样的结构而能稳定呢?层状的石墨和四面体结构的金刚石是碳的两种稳定存在形式,当60个碳原子以它们中的任何一种形式排列时,都会存在许多悬键,就会非常活泼,就不会显示出如此稳定的质谱信号。这就说明C60分子具有与石墨和金刚石完全不同的结构。由于受到建筑学家Buckminster Fuller用五边形和六边形构成的拱形圆顶建筑的启发,Kroto等认为C60是由60个碳原子组成的球形32面体,即由12个五边形和20个六边形组成,只有这样C60分子才不存在悬键。
在C60分子中,每个碳原子以sp2杂化轨道与相邻的三个碳原子相连,剩余的未参加杂化的一个p轨道在C60球壳的外围和内腔形成球面大∏键,从而具有芳香性。为了纪念Fuller,他们提出用Buckminsterfullerene来命名C60,后来又将包括C60在内的所有含偶数个碳所形成的分子通称为Fuller,中译名为富勒烯。
碳六十的制备
用纯石墨作电极,在氦气氛中放电,电弧中产生的烟炱沉积在水冷反应器的内壁上,这种烟炱中存在着C60、C70等碳原子簇的混合物。
用萃取法从烟炱中分离提纯富勒烯,将烟炱放入索氏(Soxhlet)提取器中,用甲苯或苯提取,提取液中的主要成分是C60和C70,以及少量C84和C78。再用液相色谱分离法对提取液进行分离,就能得到纯净的C60溶液。C60溶液是紫红色的,蒸发掉溶剂就能得到深红色的C60微晶。
碳六十的用途
从C60被发现的短短的十多年以来,富勒烯已经广泛地影响到物理学、化学、材料学、电子学、生物学、医药学各个领域,极大地丰富和提高了科学理论,同时也显示出有巨大的潜在应用前景。
据报道,对C60分子进行掺杂,使C60分子在其笼内或笼外俘获其它原子或集团,形成类C60的衍生物。例如C60F60,就是对C60分子充分氟化,给C60球面加上氟原子,把C60球壳中的所有电子“锁住”,使它们不与其它分子结合,因此C60F60表现出不容易粘在其它物质上,其润滑性比C60要好,可做超级耐高温的润滑剂,被视为“分子滚珠”。再如,把K、Cs、Tl等金属原子掺进C60分子的笼内,就能使其具有超导性能。用这种材料制成的电机,只要很少电量就能使转子不停地转动。再有C60H60这些相对分子质量很大地碳氢化合物热值极高,可做火箭的燃料。等等。
碳的成键特征
碳在元素周期表中属第ⅣA族头一名元素,位于非金属性最强的卤素元素和金属性最强的碱金属之间。它的价电子层结构为2s22p2,在化学反应中它既不容易失去电子,也不容易得到电子,难以形成离子键,而是形成特有的共价键,它的最高共价数显然为4。
碳原子sp3杂化
碳原子sp2杂化
碳原子sp杂化-1
碳原子sp杂化-2
碳原子sp3杂化
碳原子的sp3杂化可以生成4个δ键,形成正四面体构型。例如金刚石、甲烷CH4、四氯化碳CCl4、乙烷C2H6等。
在甲烷分子中,C原子4个sp3杂化轨道与4个H原子生成4个δ共价键,分子构型为正四面体结构。
碳原子sp2杂化
碳原子的sp2杂化生成3个δ键,1个∏键,平面三角形构型。例如石墨、COCl2、C2H4、C6H6等。
在COCl2分子中,C原子以3个sp2杂化轨道分别与2个Cl原子和1个O原子各生成1个δ共价键外,它的未参加杂化的那个p轨道中的未成对的p电子O原子中的对称性相同的1个p轨道上的p电子生成了一个∏共价键,所以在C和O原子之间是共价双键,分子构型为平面三角形。
碳原子sp杂化-1
生成2个δ键、2个∏键,直线形构型。例如CO2、HCN、C2H2等。
在CO2分子中,C原子以2个sp杂化轨道分别与2个O原子生成2个δ共价键,它的2个未参加杂化的p轨道上的2个p电子分别与2个O原子的对称性相同的2个P轨道上的3个p电子形成2个三中心四电子的大∏键,所以CO2是2个双键。
在HCN分子中,C原子分别与H和N原子各生成1个δ共价键外,还与N原子生成了2个正常的∏共价键,所以在HCN分子中是一个单键,1个叁键。
碳原子sp杂化-2
生成1个δ键,1个∏键,1个配位∏键和1对孤对电子对,直线型构型。例如在CO分子中,C原子与O原子除了生成一个δ共价键和1个正常的∏共价键外,C原子的未参加杂化的1个空的p轨道可以接受来自O原子的一对孤电子对而形成一个配位∏键,所以CO分子中C与O之间是叁键,还有1对孤电子对。
碳原子不仅仅可以形成单键、双键和叁键,碳原子之间还可以形成长长的直链、环形链、支链等等。纵横交错,变幻无穷,再配合上氢、氧、硫、磷、和金属原子,就构成了种类繁多的碳化合物。
二氧化碳
CO2是无色、无臭的气体,在大气中约占0.03%,海洋中约占0.014%,它还存在于火山喷射气和某些泉水中。地面上的CO2气主要来自煤、石油、天然气及其它含碳化合物的燃烧,碳酸钙矿石的分解,动物的呼吸以及发酵过程。当太阳光通过大气层的时候,CO2吸收波长13~17nm的红外线,如同给地球罩上一层硕大无比的塑料薄膜,留住温暖的红外线,不让它散失掉,使地球成为昼夜温差不太悬殊的温室。CO2的温室效应为生命提供了舒适的生活环境。它还为生命提供了基本的材料,它是绿色植物进行光和作用的原料。绿色植物每年通过光和作用,将大气里CO2含的15 000亿吨碳,变成纤维素、淀粉和蛋白质,并且放出O2气,供给动物和人类食用。
绿色植物一直维持着大气中O2和CO2的平衡,但近年来随着全世界工业的高速发展和由此带来的海洋污染,使大气中CO2越来越多,据估计每年约增加百万分之二到四。这被认为是对世界气温普遍升高有影响的一个重要因素。
关于CO2,我们从它的结构、性质和制备三个方面来介绍:
二氧化碳的结构
二氧化碳的性质
二氧化碳的制备
二氧化碳的结构
在CO2分子中,碳原子采用sp杂化轨道与氧原子成键。
C原子的两个sp杂化轨道分别与一个O原子生成两个δ键。C原子上两个未参加杂化的p轨道与sp杂化轨道成直角,并且从侧面同氧原子的p轨道分别肩并肩地发生重叠,生成两个∏三中心四电子的离域键。因此,缩短了碳—氧原子间地距离,使CO2中碳氧键具有一定程度的叁键特征。决定分子形状的是sp杂化轨道,CO2为直线型分子。
二氧化碳的性质
CO2分子没有极性,因此分子间作用力小,溶沸点低,键能大,原子间作用力强,分子具有很高的热稳定性。例如在2273K时CO2只有1.8%的分解:
CO2临界温度高,加压时易液化,液态CO2的汽化热很高,217K时为25.1kJ·mol-1。当液态CO2自由蒸发汽化时,一部分CO2被冷凝成雪花状的固体,这固体俗称“干冰”。它是分子晶体。在常压下,干冰不经熔化,于194.5K时直接升华气化,因此常用来做制冷剂。
CO2是酸性氧化物,它能与碱反应。工业上,纯碱Na2CO3、小苏打NaHCO3、碳酸氢氨NH4HCO3、铅白颜料Pb(OH)22PbCO3、啤酒、饮料、干冰等生产中都要食用大量的CO2。
一般讲,CO2不助燃,空气中含CO2量达到2.5%时,火焰就会熄灭。所以CO2是目前大量使用的灭火剂。但着火的镁条在CO2气中能继续燃烧,说明CO2不助燃也是相对的:
CO2不活泼,但在高温下能与碳或活泼的金属镁、铅等反应:
CO2虽然无毒,但若在空气中的含量过高,也会使人因为缺氧而发生窒息的危险。人进入地窖时应手持燃着的蜡烛,若烛灭,表示窖内CO2浓度过高,暂不宜进入。
二氧化碳的制备
在工业上可利用煅烧石灰石生产石灰以及通过酿造工业而得到大量的CO2副产物。
在实验室中则常用碳酸盐和盐酸作用来制备CO2:
一氧化碳
CO也是一种无色、无臭的气体,我们介绍它的结构、性质和制备方法。
CO的结构
CO的性质
CO的制备
CO的结构
按照杂化轨道理论,在CO分子中,碳原子采取sp杂化与氧原子成键。
C原子的2个p电子可与O原子的2个成单的p电子形成一个δ键和一个∏键,O原子上的成对的p电子还可以与C原子上的一个空的2p轨道形成一个配位键。(配位键定义:由一个原子提供电子对为两个原子所共用而形成的共价键,称为配位键)。用←表示配键,箭头指向接受电子对的原子,此处即成键的一对电子是O原子单独提供的,C原子提供空轨道接受电子。其结构式可表示为:
按照分子轨道理论,从CO分子的分子轨道能级图可以看出,C原子核外有4个价电子,其电子结构式为2s22p2;O原子核外有6个价电子,其电子结构式为2s22p4,由于C和O原子的相应的原子轨道能量相近,互相重叠形成CO分子的分子轨道。CO分子的价键结构式可以表示为:
[1]式中的箭头表示由氧单方面提供一对电子为两个原子共用而形成的共价键,亦称为配位键。
[2]式中的表示∏配位键,两个圆点偏于一边,则表示这电子在原子状态时是在氧原子的轨道上,而在形成CO分子后,也还是比较靠近氧原子核的。
这种包含有配位键的三重键结构能够圆满地解释键能大、键长短、偶极矩几乎等于零的事实。如果没有配位键的话,CO应该是极性很强的分子,因为O原子的电负性要比C原子大得多,但是配位键的存在,使O原子略带正电荷,C原子略带负电荷,两种因素相互抵消,所以CO的偶极矩几乎等于零。
CO分子和N2分子中各有10个价电子,它们是等电子体,亦称为等电子分子。等电子分子轨道电子排布和成键情况及性质非常相似。
在CO分子中,因C原子略带负电荷,这个C原子比较容易向其它有空轨道的原子提供电子对形成配位键并生成许多羰基化合物。这也是CO分子的键能虽然比N2分子的大,而它却比较活泼的一个原因。
CO的性质
(1)、CO是一种很好的还原剂
在高温下,CO可以从许多金属氧化物中夺取氧,使金属还原。冶金工业中用焦碳作还原剂,实际上起重要作用的是CO:
在常温下,CO还能使一些化合物中的金属离子还原。例如:CO能使二氯化钯溶液、银氨溶液变黑,反应十分灵敏,可用于检测微量CO的存在:
CO是一种重要的配体它能与许多过渡金属加合生成金属羰基化合物。例如Fe(CO)5、Ni(CO)4和Cr(CO)6等。我们以Ni(CO)4为例来说明羰基化合物的成键特征。
在金属羰基化合物中,CO以C和金属相连。从CO的分子轨道能级图我们已经知道,CO一方面有非键电子对(孤电子对)可以给予金属原子的空轨道,形成δ配位键。另一方面,CO还有空的反键∏道可以接受金属原子的d电子对,与金属原子的d轨道重叠生成∏键。这种∏键是由金属原子单方面提供电子对到配位体(CO)的空轨道上,所以称为反馈键或配位∏键。反馈键正好可以减少由于生成δ配键引起的金属原子上过多的负电荷的积累。
在羰基化合物中,金属呈低氧化态,具有较多的价电子,有利于形成反馈键。如在Ni(CO)4中,Ni原子为零价,价电子为3d84s2,Ni原子采用sp3杂化轨道接受4个CO提供的非键电子对形成δ配位键。另外Ni原子上的d电子对反馈到CO的空的反键∏*轨道上去,生成反馈键。由于δ配位键和反馈键两种成键作用是同时进行的,使金属与CO生成的羰基化合物具有很高的稳定性。
羰基化合物一般是剧毒的。CO对动物和人类的高度毒性亦产生于它的加合作用,它能与血液中的血红素(一种Fe的配合物)结合生成羰基化合物,使血液失去输送氧的作用,导致组织低氧症,如果血液中50%的血红素与CO结合,即可引起心肌坏死。空气中只要有1/800体积比的CO就能使人在半小时内死亡。(1aroman 、CO相当活泼它很容易同O、S、H以及卤素F2、Cl2、Br2相化合。
①CO能在空气中燃烧,生成CO2,并放出大量的热:
②CO与H2反应,可生成甲醇和某些有机化合物:
③CO与S反应,生成硫化碳酰:
④CO与卤素F2、Cl2、Br2反应,可以生成卤化碳酰,卤化碳酰很容易被水分解,并与氨作用生成尿素:
氯化碳酰又名“光气”,是极毒的。但它是以较大的量而生产的,用于制造甲苯二异氰酸酯,这是生产聚氨酯塑料的一种中间体。
CO的制备
实验室制备CO气体的方法:
(1)、甲酸滴加到热的浓硫酸中脱水:
(2)、将草酸晶体与浓硫酸共热:
使反应中产生的混合气体通过固体NaOH,吸收掉CO2而得到纯的CO气体。
工业上制备CO气体的方法:
工业上CO的主要来源为水煤气、发生炉煤气和煤气。
水煤气CO和H2的一种等分子混合物,是由空气和水蒸气交替地通入赤热的碳层时得到的:
发生炉煤气是CO和N2(CO占二分之一体积)的混合物,是由有限量的空气通过赤热的碳层时反应得到的:
煤气是CO、H2、CH4和CO2的一种混合物。水煤气、发生炉煤气和煤气都是重要的工业气体燃料。
碳酸和碳酸盐
CO2能溶于水生成碳酸H2CO3,碳酸是一种弱酸,仅存在于水溶液中,pH约等于4。
H2CO3为二元酸,必能生成两类盐:碳酸盐和碳酸氢盐。
C原子在这两种离子中均采取sp2杂化轨道与外来的4个电子生成四个键,离子为平面三角形。了解这两类盐在水中的溶解性、水解性和热稳定性很重要。
溶解性
水解性
热稳定性
溶解性
碳酸盐:铵和碱金属(Li除外)的碳酸盐易溶于水。其它金属的碳酸盐难溶于水。例如(NH4)2CO3、Na2CO3、K2CO3等易溶于水,CaCO3、MgCO3等难溶于水。
碳酸氢盐:对于难溶的碳酸盐来说,其相应的碳酸氢盐却有较大的溶解度。例如难溶的碳酸钙矿石在CO2和水的长期侵蚀下,可以部分地转变为Ca(HCO3)2而溶解:
对于易溶的碳酸盐来说,其相应的碳酸氢盐却有相对较低的溶解度。例如向浓的碳酸氨溶液通入CO2至饱和,便可沉淀出NH4HCO3,这是工业上生产碳铵肥料的基础。
溶解度的反常是由于HCO3-离子通过氢键形成双聚或多聚链状有关:
水解性
碱金属和铵的碳酸盐和碳酸氢盐在水溶液中均因水解而分别显强碱性和弱减性:
在金属盐类(碱金属和铵盐除外)溶液中加入 CO32-离子时,产物可能是碳酸盐、碱式碳酸盐或氢氧化物,究竟是哪种产物呢?一般来说:
(1)氢氧化物碱性较强的离子,即不水解的金属离子,可沉淀为碳酸盐。例如:
(2)氢氧化物碱性较弱的离子,如Cu2+、Zn2+、Pb2+、Mg2+等,其氢氧化物和碳酸盐的溶解度相差不多,则可沉淀为碱式碳酸盐。例如:
(3)强水解性的金属离子,特别是两性的,其氢氧化物的溶度积小的离子,如Al3+、Cr3+、Fe3+等,将沉淀为氢氧化物。例如:
因此碳酸钠、碳酸铵常用作金属离子的沉淀剂。
热稳定性
热不稳定性是碳酸盐的一个重要性质,一般来说,有下列热稳定性顺序:
碱金属的碳酸盐>碱土金属碳酸盐>副族元素和过渡元素的碳酸盐
在碱金属和碱土金属各族中,阳离子半径大的碳酸盐>阳离子半径小的碳酸盐。
碳酸盐受热分解的难易程度还与阳离子的极化作用有关。